Die Komplexität des Phänomens
Die Familie der Autoimmunkrankheiten ist sehr groß, und die Erkrankungen, die dieser Kategorie zugeordnet werden können, sind sowohl in Bezug auf die Schwere der Krankheit als auch auf den Bereich der organischen Schädigung unterschiedlich.
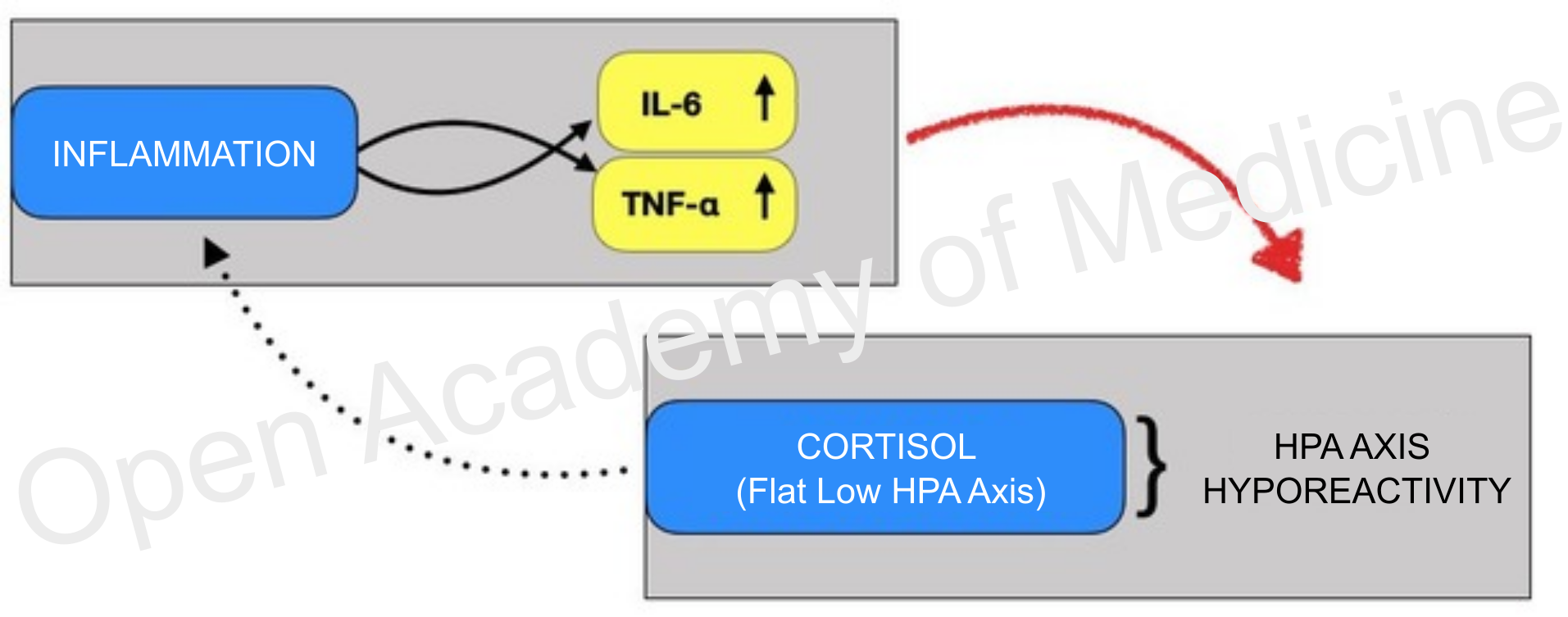
Das Gebiet der Autoimmunkrankheiten umfasst daher Hauterkrankungen wie atopische Dermatitis oder Psoriasis, chronische Schmerzformen wie rheumatoide Arthritis, Polymyalgia rheumatica, Fibromyalgie, CFS (Chronic Fatigue Syndrome, chronisches Erschöpfungssyndrom), Atemwegserkrankungen allergischer und entzündlicher Natur (allergische Rhinitis, Asthma), Atherosklerose, Multiple Sklerose, allergische Konjunktivitis. Die Autoimmunkrankheiten sind trotz ihrer offensichtlichen Unterschiede alle durch eine chronische Entzündung gekennzeichnet [9,11,16,18,19,21,31,51,58]. Diese geht mit einer neuroendokrinen Veränderung einher, die das Abklingen des Entzündungsherdes verhindert. Bei allen genannten Krankheiten wird daher ein Anstieg der Expression von proinflammatorischen Zytokinen wie IL-2, IL-6 und TNF-α [8,60] sowie von Entzündungsmarkern (z. B. C-reaktives Protein) festgestellt. [15]
Alle Studien zeigen bei diesen Krankheiten ein Defizit in der Reaktion der immunendokrinen Achse, was zur Schwierigkeit bzw. Unfähigkeit führt, die laufende Entzündungsaktivität zu reduzieren. [1,10,15,26-28,31,41,43-45,49,51,53,56,59,62]
![]()
Abbildung 1: Die Reaktion der immunendokrinen Achse ist nicht in der Lage, die Entzündung zu lindern
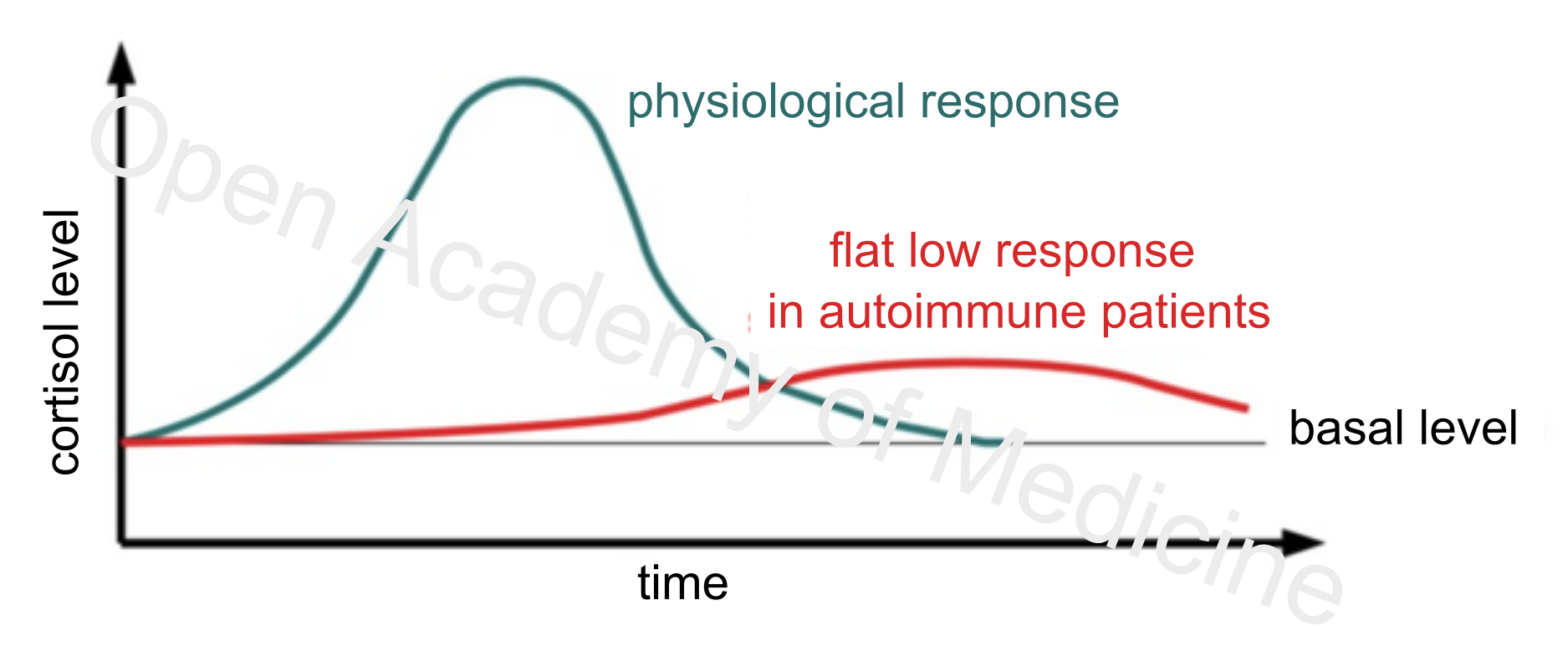
Während sich die Basiskonzentrationen von Cortisol und ACTH bei den Messungen von Patienten und Kontrollprobanden nicht signifikant zu unterscheiden scheinen, ist das Absinken des Verhältnisses von Cortisol zu C-reaktivem Protein und ACTH zu C-reaktivem Protein auffällig; auch der ACTH-Stimulationstest führt bei Patienten zu einer stark abgeschwächten Cortisolfreisetzung. [5,24,36,47]
Die Hypofunktionalität der HPA-Achse (HPA Axis Index: Flat Low, BIA-ACC) oder zumindest ihres Stellvertreters, der Nebennierenrinde, scheint eines der Hauptmerkmale der Autoimmunformen zu sein. Neben einer unzureichenden Cortisolsekretion als Reaktion auf Stressereignisse gibt es jedoch auch eine gewisse Resistenz oder Trägheit, die die Wiederherstellung des Basalcortisolspiegels verlangsamt. Das ist ein Merkmal, das zum Verlust der zirkadianen Rhythmik der neuroimmunendokrinen Achse und zur häufigen arrhythmischen Absenkung und Abflachung des Basalcortisolspiegels beiträgt, die oft durch die Hemmung der Schilddrüsenfunktion (hypophysische Absenkung von TSH und GH) noch verstärkt wird. [12,22,29,30,37,40,54]
![]()
Abbildung 2: Physiologische Reaktion auf ein Stressereignis und Reaktion bei Autoimmunpatienten
Die Veränderung der HPA-Achse und der Interaktionen mit dem sympathischen Nervensystem (PPG Stress Flow) scheint jedoch nicht unter der allgemeinen Definition der Hypofunktionalität gelöst werden zu können, da zumindest im Hypothalamus und bei der Freisetzung von CRH die Situation auch umgekehrt sein kann, mit einem zentralem und peripherem (entzündungsförderndem) Überschuss an CRH [6,35,48,52,63], der auch mit der Abnahme von TSH und GH korreliert ist. Andere Erfahrungen zeigen einen Anstieg des basalen Noradrenalin-Gehalts (aufgrund einer Überstimulation des sympathischen Nervensystems - SNS) und der Noradrenalin-Reaktion auf Entzündungsreize (insbesondere auf den Anstieg von IL-6) bei Fibromyalgie-Patienten [2,3,38,50], was die veränderte Regulierung des sympathischen Nervensystems unterstreicht (Anstieg der Herzfrequenz nach Stress, Hemmung der Insulinsekretion, Veränderung der Thermoregulation usw.).
Autoimmunity-related issues:
Genesungsstrategien
Autoimmunformen werden also unabhängig von der Ursache durch einen Entzündungszustand ausgelöst sowie durch die Unfähigkeit der neuroimmunendokrinen Reaktion, die Entzündung einzudämmen und schließlich zum Erlöschen zu bringen, was zu einer Schädigung des gesunden Gewebes führt.
Die Notwendigkeit, die durch chronische Entzündungen verursachten Schäden zu begrenzen, ist daher offensichtlich. Wichtig ist also, den Grad der systemischen Entzündung zu berücksichtigen (mittels ECW extrazelluläres Wasser - BIA-ACC, RMSSD Vagus-Aktivität und Kapillarpermeabilität - PPG Stress Flow) und Strategien zur schrittweisen Senkung dieses Grades anzuwenden, um die Häufigkeit oder zumindest die Intensität der Symptome zu verringern. Durch die Integration sehr nützlicher Informationen ist es möglich, in kurzer Zeit wichtige biologische Rhythmen wiederherzustellen, die mit dem Fortbestehen des Entzündungsprozesses verloren gegangen sind.
Das erste Ziel besteht darin, aus biologischer, physikalischer und metabolischer Sicht eine Rhythmik zwischen Akrophase und Bathyphase zu schaffen. Die Dominanz des Sympathikus (Gamma LF – sympathisches Nervensystem - PPG Stress Flow) während des Tages und die Dominanz des Parasympathikus (Gamma HF – parasympathisches Nervensystem - PPG Stress Flow) während der Abendstunden ermöglicht es uns, diese Rhythmik zu gewährleisten.
Eine angemessene Ergänzung mit Puffersystemen ist auch nützlich, um der subklinischen Azidose entgegenzuwirken, die typischerweise mit chronischen Entzündungen einhergeht.
Ebenso sinnvoll ist eine negative PRAL-Diät, die auch die richtige glykämische Last (GL) zwischen Tag und Nacht berücksichtigt. Diese soll einerseits der mit der Entzündungslast verbundenen subklinischen Azidose entgegenwirken, andererseits aber auch die Akrophase energetisch unterstützen (synchrone Nervensystem und Cortisol).
Um den Entzündungsgrad zu senken, sollte neben der Stimulierung des immunendokrinen Systems die Zufuhr von mehrfach ungesättigten Omega-3-Fettsäuren in Betracht gezogen werden: EPA und DHA sind besonders geeignet, Entzündungsprozesse im Zusammenhang mit Autoimmunkrankheiten zu unterdrücken. Dies erfolgt vor allem durch die Hemmung der Synthese von entzündungsfördernden Eicosanoiden, die von Arachidonsäure (Omega-6) abgeleitet sind. [13,20,23,25,33-34,39,42,46,61] Es gibt zahlreiche Hinweise auf ein Absinken der wichtigsten Entzündungsmarker (insbesondere IL-6 und TNF-α) nach einer Supplementierung mit diesen Omega-3-Fettsäuren. [23,66]
Jüngste Studien [7,14,17,64] haben gezeigt, dass Hopfenextrakte (Humulus lupulus L.) eine entzündungshemmende Wirkung haben, indem sie den Spiegel des C-reaktiven Proteins senken. Das wurde insbesondere bei der Behandlung chronischer Schmerzen festgestellt wie rheumatoider Arthritis und anderer Krankheiten, die mit dem Fortbestehen des Entzündungsprozesses in Verbindung mit chronischem Stress einhergehen.
Autoren: Dario Boschiero, Mariantonietta Lucafò - Datum: 22/02/2021
Achtung: Die Inhalte dürfen ausschließlich für persönliche Lernzwecke frei verwendet werden. Die Nutzung wird durch Gesetz Nr. 633/1941 und darauffolgende Änderungen sowie durch das Urheber- und Patentrecht geregelt. Jegliche Nutzung zu kommerziellen und gewinnorientierten Zwecken ist verboten.
Literaturverzeichnis
- Sulli A, Montecucco CM, Caporali R, Cavagna L, Montagna P, Capellino S, Fazzuoli L, Seriolo B, Alessandro C, Secchi ME, Cutolo M. Glucocorticoid effects on adrenal steroids and cytokine responsiveness in polymyalgia rheumatica and elderly onset rheumatoid arthritis. Ann N Y Acad Sci. 1069:307-14; 2006
- Sarzi-Puttini P, Atzeni F, Diana A, Doria A, Furlan R. Increased neural sympathetic activation in fibromyalgia syndrome. Ann N Y Acad Sci.1069:109-17; 2006
- Geenen R, Van Middendorp H, Bijlsma JW. The impact of stressors on health status and hypothalamic-pituitary-adrenal axis and autonomic nervous system responsiveness in rheumatoid arthritis. Ann N Y Acad Sci.1069:77-97; 2006
- Harbuz MS, Richards LJ, Chover-Gonzalez AJ, Marti-Sistac O, Jessop DS. Stress in autoimmune disease models. Ann N Y Acad Sci.;1069:51-61; 2006
- Demir H, Tanriverdi F, Ozogul N, Calis M, Kirnap M, Durak AC, Kelestimur F. Evaluation of the hypothalamic-pituitary-adrenal axis in untreated patients with polymyalgia rheumatica and healthy controls. Scand J Rheumatol. 35(3):217-23; 2006
- O'Kane M, Murphy EP, Kirby B. The role of corticotropin-releasing hormone in immune-mediated cutaneous inflammatory disease. Exp Dermatol.15(3):143-53; 2006
- Hougee S, Faber J, Sanders A, Berg WB, Garssen J, Smit HF, Hoijer MA. Selective inhibition of COX-2 by a standardized CO2 extract of Humulus lupulus in vitro and its activity in a mouse model of zymosan-induced arthritis. Planta Med. 72(3):228-33; 2006
- Gabay C. Interleukin-6 and chronic inflammation. Arthritis Res Ther. 8 Suppl 2:S3. 2006
- Hamminga EA, van der Lely AJ, Neumann HA, Thio HB. Chronic inflammation in psoriasis and obesity: implications for therapy. Med Hypotheses. 67(4):768-73. 2006
- Richards HL, Ray DW, Kirby B, Mason D, Plant D, Main CJ, Fortune DG, Griffiths CE. Response of the hypothalamic-pituitary-adrenal axis to psychological stress in patients with psoriasis. Br J Dermatol. 153(6):1114-20; 2005
- Knoflach M, Kiechl S, Mayr A, Willeit J, Poewe W, Wick G. Allergic rhinitis, asthma, and atherosclerosis in the Bruneck and ARMY studies. Arch Intern Med. 165(21):2521-6; 2005.
- Cutolo M, Villaggio B, Otsa K, Aakre O, Sulli A, Seriolo B. Altered circadian rhythms in rheumatoid arthritis patients play a role in the disease's symptoms. Autoimmun Rev. 4(8):497-502. 2005
- Wolters M. Diet and psoriasis: experimental data and clinical evidence. Br J Dermatol. 153(4):706-14; 2005
- Lukaczer D, Darland G, Tripp M, Liska D, Lerman RH, Schiltz B, Bland JS. A pilot trial evaluating Meta050, a proprietary combination of reduced iso-alpha acids, rosemary extract and oleanolic acid in patients with arthritis and fibromyalgia. Phytother Res.19(10):864-9; 2005
- Eijsbouts AM, van den Hoogen FH, Laan RF, Hermus AR, Sweep CG, van de Putte LB. Hypothalamic-pituitary-adrenal axis activity in patients with rheumatoid arthritis. Clin Exp Rheumatol. 23(5):658-64; 2005
- Bos JD, de Rie MA, Teunissen MB, Piskin G. Psoriasis: dysregulation of innate immunity. Br J Dermatol. 152(6):1098-107; 2005
- Yahiro K, Shirasaka D, Tagashira M, Wada A, Morinaga N, Kuroda F, Choi O, Inoue M, Aoyama N, Ikeda M, Hirayama T, Moss J, Noda M. Inhibitory effects of polyphenols on gastric injury by Helicobacter pylori VacA toxin. Helicobacter. 10(3):231-9; 2005
- Messmer EM. Ocular allergies. Ophthalmologe. 102(5):527-43; 2005
- Goronzy JJ, Weyand CM. Rheumatoid arthritis. Immunol Rev.204:55-73; 2005
- Denburg JA, Hatfield HM, Cyr MM, Hayes L, Holt PG, Sehmi R, Dunstan JA, Prescott SL. Fish oil supplementation in pregnancy modifies neonatal progenitors at birth in infants at risk of atopy. Pediatr Res. 57(2):276-81; 2005
- Groneberg DA, Bester C, Grutzkau A, Serowka F, Fischer A, Henz BM, Welker P. Mast cells and vasculature in atopic dermatitis--potential stimulus of neoangiogenesis. Allergy. 60(1):90-7; 2005
- McBeth J, Chiu YH, Silman AJ, Ray D, Morriss R, Dickens C, Gupta A, Macfarlane GJ. Hypothalamic-pituitary-adrenal stress axis function and the relationship with chronic widespread pain and its antecedents. Arthritis Res Ther. 7(5):R992-R1000; 2005
- Mori TA, Beilin LJ. Omega-3 fatty acids and inflammation, Curr Atheroscler Rep;6(6):461-7; 2004
- Crofford LJ, Young EA, Engleberg NC, Korszun A, Brucksch CB, McClure LA, Brown MB, Demitrack MA. Basal circadian and pulsatile ACTH and cortisol secretion in patients with fibromyalgia and/or chronic fatigue syndrome. Brain Behav Immun. 18(4):314-25; 2004
- Barden AE, Mori TA, Dunstan JA, Taylor AL, Thornton CA, Croft KD, Beilin LJ, Prescott SL. Fish oil supplementation in pregnancy lowers F2-isoprostanes in neonates at high risk of atopy.Free Radic Res. 38(3):233-9; 2004
- Raap U, Werfel T, Jaeger B, Schmid-Ott G. Atopic dermatitis and psychological stress. Hautarzt. 54(10):925-9; 2003
- Buske-Kirschbaum A, von Auer K, Krieger S, Weis S, Rauh W, Hellhammer D. Blunted cortisol responses to psychosocial stress in asthmatic children: a general feature of atopic disease?. Psychosom Med.65(5):806-10; 2003
- Buske-Kirschbaum A, Hellhammer DH. Endocrine and immune responses to stress in chronic inflammatory skin disorders. Ann N Y Acad Sci.992:231-40; 2003
- Cutolo M, Sulli A, Pizzorni C, Craviotto C, Straub RH. Hypothalamic-pituitary-adrenocortical and gonadal functions in rheumatoid arthritis. Ann N Y Acad Sci.992:107-17; 2003
- Ataoglu S, Ozcetin A, Yildiz O, Ataoglu A. Evaluation of dexamethasone suppression test in fibromyalgia patients with or without depression. Swiss Med Wkly. 133(15-16):241-4; 2003
- Eichenfield LF, Hanifin JM, Beck LA, Lemanske RF Jr, Sampson HA, Weiss ST, Leung DY. Atopic dermatitis and asthma: parallels in the evolution of treatment. Pediatrics.111(3):608-16; 2003
- Harle P, Cutolo M, Scholmerich J, Straub RH. Rheumatoid arthritis - pathogenetic role of neuroendocrine axes and the peripheral nervous system. Med Klin (Munich). 97(12):720-9; 2002
- Simopoulos AP. Omega-3 fatty acids in inflammation and autoimmune diseases. J Am Coll Nutr. 21(6):495-505; 2002
- Gil A. Polyunsaturated fatty acids and inflammatory diseases. Biomed Pharmacother. 56(8):388-96; 2002
- Tsigos C, Chrousos GP. Hypothalamic-pituitary-adrenal axis, neuroendocrine factors and stress. J Psychosom Res. 53(4):865-71; 2002
- Harbuz M. Neuroendocrine function and chronic inflammatory stress. Exp Physiol. 87(5):519-25; 2002
- Bennett RM. Adult growth hormone deficiency in patients with fibromyalgia. Curr Rheumatol Rep. 4(4):306-12; 2002
- Okifuji A, Turk DC. Stress and psychophysiological dysregulation in patients with fibromyalgia syndrome. Appl Psychophysiol Biofeedback. 27(2):129-41; 2002
- Mayser P, Mayer K, Mahloudjian M, Benzing S, Kramer HJ, Schill WB, Seeger W, Grimminger F. A double-blind, randomized, placebo-controlled trial of n-3 versus n-6 fatty acid-based lipid infusion in atopic dermatitis. JPEN J Parenter Enteral Nutr.;26(3):151-8; 2002
- Geenen R, Jacobs JW, Bijlsma JW. Evaluation and management of endocrine dysfunction in fibromyalgia. Rheum Dis Clin North Am. 28(2):389-404; 2002
- Cutolo M, Straub RH, Foppiani L, Prete C, Pulsatelli L, Sulli A, Boiardi L, Macchioni P, Giusti M, Pizzorni C, Seriolo B, Salvarani C. Adrenal gland hypofunction in active polymyalgia rheumatica. effect of glucocorticoid treatment on adrenal hormones and interleukin 6. J Rheumatol. 29(4):748-56; 2002
- Mayser P, Grimm H, Grimminger F. n-3 fatty acids in psoriasis. Br J Nutr. 87 Suppl 1:S77-82; 2002
- Cutolo M, Foppiani L, Minuto F. Hypothalamic-pituitary-adrenal axis impairment in the pathogenesis of rheumatoid arthritis and polymyalgia rheumatica. J Endocrinol Invest. 25(10 Suppl):19-23; 2002
- Parker AJ, Wessely S, Cleare AJ. The neuroendocrinology of chronic fatigue syndrome and fibromyalgia. Psychol Med.31(8):1331-45; 2001
- Morand EF, Leech M. Hypothalamic-pituitary-adrenal axis regulation of inflammation in rheumatoid arthritis. Immunol Cell Biol.;79(4):395-9; 2001
- Furse RK, Rossetti RG, Zurier RB. Gammalinolenic acid, an unsaturated fatty acid with anti-inflammatory properties, blocks amplification of IL-1 beta production by human monocytes. J Immunol.167(1):490-6; 2001
- Dekkers JC, Geenen R, Godaert GL, Glaudemans KA, Lafeber FP, van Doornen LJ, Bijlsma JW. Experimentally challenged reactivity of the hypothalamic pituitary adrenal axis in patients with recently diagnosed rheumatoid arthritis. J Rheumatol. 28(7):1496-504; 2001
- Neeck G, Crofford LJ. Neuroendocrine perturbations in fibromyalgia and chronic fatigue syndrome. Rheum Dis Clin North Am. 26(4):989-1002; 2000
- Straub RH, Gluck T, Cutolo M, Georgi J, Helmke K, Scholmerich J, Vaith P, Lang B. The adrenal steroid status in relation to inflammatory cytokines (interleukin-6 and tumour necrosis factor) in polymyalgia rheumatica. Rheumatology (Oxford). 39(6):624-3; 2000
- Torpy DJ, Papanicolaou DA, Lotsikas AJ, Wilder RL, Chrousos GP, Pillemer SR. Responses of the sympathetic nervous system and the hypothalamic-pituitary-adrenal axis to interleukin-6: a pilot study in fibromyalgia. Arthritis Rheum. 43(4):872-80; 2000
- Mastorakos G, Ilias I. Relationship between interleukin-6 (IL-6) and hypothalamic-pituitary-adrenal axis hormones in rheumatoid arthritis.Z Rheumatol. 59 Suppl 2:II/75-9; 2000
- Eijsbouts AM, Murphy EP. The role of the hypothalamic-pituitary-adrenal axis in rheumatoid arthritis. Baillieres Best Pract Res Clin Rheumatol. 13(4):599-613; 1999
- Winfield JB. Pain in fibromyalgia. Rheum Dis Clin North Am. 25(1):55-79; 1999
- Demir H, Kelestimur F, Tunc M, Kirnap M, Ozugul Y. Hypothalamo-pituitary-adrenal axis and growth hormone axis in patients with rheumatoid arthritis. Scand J Rheumatol. 28(1):41-6; 1999
- Buske-Kirschbaum A, Jobst S, Hellhammer DH. Altered reactivity of the hypothalamus-pituitary-adrenal axis in patients with atopic dermatitis: pathologic factor or symptom?.Ann N Y Acad Sci. 840:747-54; 1998
- Demitrack MA, Crofford LJ. Evidence for and pathophysiologic implications of hypothalamic-pituitary-adrenal axis dysregulation in fibromyalgia and chronic fatigue syndrome. Ann N Y Acad Sci.840:684-97; 1998
- Crofford LJ. The hypothalamic-pituitary-adrenal stress axis in fibromyalgia and chronic fatigue syndrome. Z Rheumatol. 57 Suppl 2:67-71; 1998
- Jongen-Lavrencic M, Peeters HR, Wognum A, Vreugdenhil G, Breedveld FC, Swaak AJ. Elevated levels of inflammatory cytokines in bone marrow of patients with rheumatoid arthritis and anemia of chronic disease. J Rheumatol. 24(8):1504-9; 1997
- Buske-Kirschbaum A, Jobst S, Psych D, Wustmans A, Kirschbaum C, Rauh W, Hellhammer D, Attenuated free cortisol response to psychosocial stress in children with atopic dermatitis. Psychosom Med. 59(4):419-26; 1997
- Di Girolamo N, Visvanathan K, Lloyd A, Wakefield D. Expression of TNF-alpha by human plasma cells in chronic inflammation. J Leukoc Biol. 61(6):667-78; 1997
- Calder PC, n-3 polyunsaturated fatty acids and cytokine production in health and disease. Ann Nutr Metab. 41(4):203-34; 1997
- Crofford LJ, Engleberg NC, Demitrack MA. Neurohormonal perturbations in fibromyalgia. Baillieres Clin Rheumatol. 10(2):365-78; 1996
- Nishioka T, Kurokawa H, Takao T, Kumon Y, Nishiya K, Hashimoto K. Differential changes of corticotropin releasing hormone (CRH) concentrations in plasma and synovial fluids of patients with rheumatoid arthritis (RA). Endocr J. 43(2):241-7. 1996
- I. Kyrou, A. Christou, D. Panagiotakos, C.Stefanaki, K.Skenderi, K. Katsana, C. Tsigos. Effects of a hops (Humulus lupulus L.) dry extract supplement on self- reported depression, anxiety and stress levels in apparently healthy young adults: a randomized, placebo-controlled, double-blind, crossover pilot study. Hormones. 16(2):171-180. 2017
- Wall R, Ross RP, Fitzgerald. Fatty acids from fish: the anti-inflammatory potential of long-chain omega-3 fatty acids. Nutr Rev;68(5):280-9. 2010